DNA拓扑异构酶IIα(TOP2A)是一种控制DNA拓扑结构并调节DNA复制和基因表达的关键酶。作为重要的抗肿瘤药物靶点,TOP2A广泛参与多种肿瘤化疗耐药的形成[1]。大连理工大学张嘉宁教授团队此前在染色质结合的O-GlcNAc糖蛋白定量质谱分析中发现,TOP2A在乳腺癌细胞MCF-7及其阿霉素耐药株MCF-7/ADR中可能存在O-GlcNAc糖基化修饰,且修饰水平伴随耐药性增强[2]。
2023年5月,张嘉宁团队在EMBO Reports上发表题为O-GlcNAcylation boosts topoisomerase IIα catalytic activity in breast cancer chemoresistance的研究成果,发现了TOP2A的O-GlcNAc修饰在乳腺癌细胞和患者肿瘤组织中的重要作用,并进一步解析了糖基化TOP2A调控乳腺癌化疗耐药的相关机制(图1)[3]。
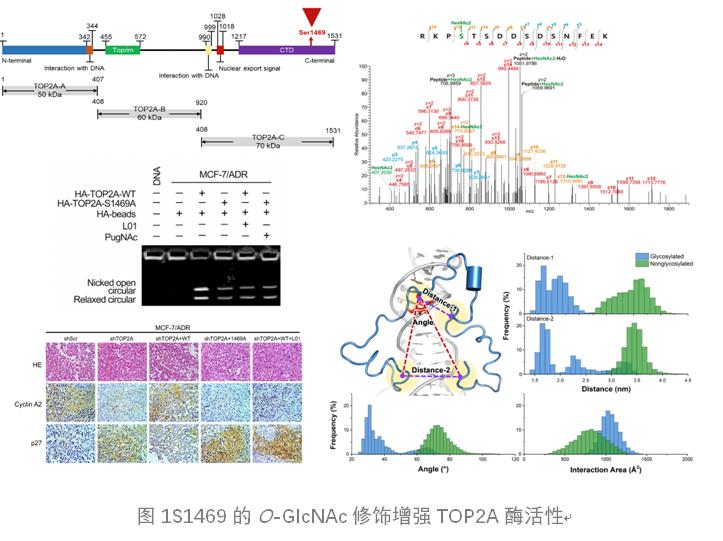
论文对乳腺癌临床样本的mRNA和蛋白表达谱分析发现,TOP2A在乳腺癌组织中随肿瘤进展表达升高,且与肿瘤组织中全细胞O-GlcNAc修饰水平和患者预后不良呈正相关。进一步在阿霉素敏感和耐药乳腺癌细胞中发现,耐药细胞中的TOP2A能与更多的OGT发生互作,并因此具有更多的O-GlcNAc修饰。O-GlcNAc修饰位点质谱分析显示,耐药细胞中TOP2A的O-GlcNAc修饰主要位于C端核定位信号区域的Ser1469位。位点突变分析证实位点特异性O-GlcNAc修饰能够促进TOP2A的磷酸化修饰和核定位。对TOP2A酶活性分析结果显示,糖基化的TOP2A具有良好的超螺旋质粒解旋酶活性。糖基化位点突变或使用O-GlcNAc修饰抑制剂能够明显减弱TOP2A解旋酶活。利用kDNA的解连锁酶活检测获得了一致的结论,提示O-GlcNAc修饰对TOP2A酶活性有重要影响。糖基化的TOP2A在阿霉素的作用下依然具有很强的解超螺旋和解连锁活性,而糖基化位点突变后,阿霉素的作用显著抑制了TOP2A的酶活性,这提示糖基化可能改变了TOP2A与DNA形成的剪切中间体的结构,使得阿霉素丢失了作用靶点,因此TOP2A的糖基化是乳腺癌细胞阿霉素耐药原因之一,能够显著促进乳腺癌细胞的增殖和周期进展。体内、体外相关机制分析结果表明,TOP2A的O-GlcNAc修饰能够增强其与DNA结合,增强其与CDK1、UPF1等周期关键因子的互作,进而改变下游多个周期调控因子的表达水平,最终导致耐药乳腺癌细胞的增殖和周期进展加速。
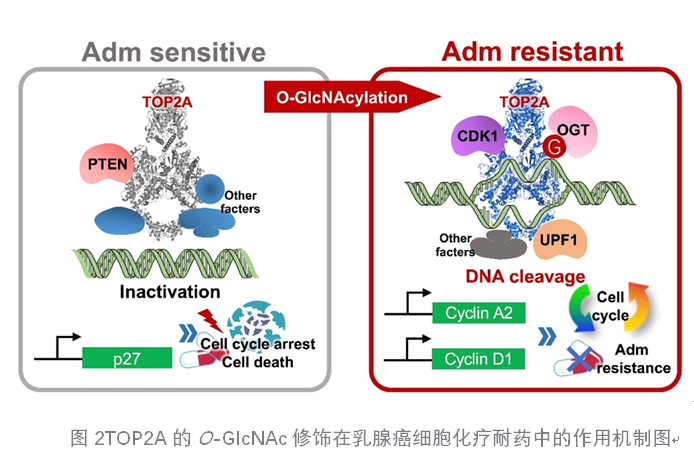
TOP2A的O-GlcNAc糖基化可通过增强其酶活性,降低阿霉素对TOP2A的抑制作用,加速细胞增殖和周期进程,最终导致化疗药耐药的发生(图2)。这项研究揭示了O-GlcNAc修饰调控TOP2A功能以及乳腺癌耐药的分子机制,为肿瘤耐药研究和治疗提供了潜在新靶点。
论文共同第一作者为大连理工大学生命科学与药学学院博士生刘阳芷和硕士生于恺然,张嘉宁教授、刘宇博副教授和中国科学院大连化学物理研究所的吴思晋副研究员为共同通讯作者。研究工作得到国家自然科学基金(32171282)和中央高校基本科研基金(DUT22YG131)的资助。
参考文献
1. Pommier Y, Nussenzweig A, Takeda S, Austin C (2022) Human topoisomerases and their roles in genome stability and organization. Nat Rev Mol Cell Biol 23: 407 – 427.
2. Liu, Y., Chen, Q., Zhang, N., Zhang, K., Dou, T., Cao, Y., ... & Zhang, J. (2020). Proteomic profiling and genome-wide mapping of O-GlcNAc chromatin-associated proteins reveal an O-GlcNAc-regulated genotoxic stress response. Nature communications, 11(1), 5898.
3. Liu, Y., Yu, K., Zhang, K., Niu, M., Chen, Q., Liu, Y., ... & Liu, Y. (2023). O‐GlcNAcylation promotes topoisomerase IIα catalytic activity in breast cancer chemoresistance. EMBO reports, e56458.