硫氧还蛋白还原酶1(Thioredoxin reductase,TXNRD1)是一类含硒的氧化还原酶,在调控细胞氧化还原稳态中发挥至关重要的作用。近年来,研究发现TXNRD1在多种恶性肿瘤中上调表达,并促进肿瘤的发生、发展与转移,因此被广泛认为是极具潜力的抗肿瘤药物靶点。围绕其活性催化中心,已有小分子抑制剂被筛选、设计和开发,并在体内外模型中展现出良好抗肿瘤活性。然而,TXNRD1催化机制尚不完全清晰,尤其是在其与生理底物的识别规律方面仍存在较多未知,制约了相关靶向药物的理性设计与深入开发。
化工海洋与生命学院许建强副教授团队围绕TXNRD1的底物识别与催化机制开展深入研究,结合酶稳态动力学分析、蛋白热稳定性检测、Alphafold结构预测等多种生物化学与生物物理手段,系统阐明了TXNRD1识别其生理底物14 kDa的硫氧还蛋白相关蛋白(TRP14;TXNDC17)的关键分子机制。研究发现,位于TXNRD1表面一处高度保守的色氨酸残基—Trp114,是其识别生理底物TRP14还原的“分子钥匙”。该位点可能通过形成氢键,促进TXNRD1的C端催化结构域靠近TRP14的关键二硫键(Cys43-Cys46),进而完成底物的还原反应。突变实验进一步证明,Trp114位点突变导致TXNRD1完全丧失对TRP14的还原能力,表明该残基在其酶催化活性中具有不可代替的重要作用。
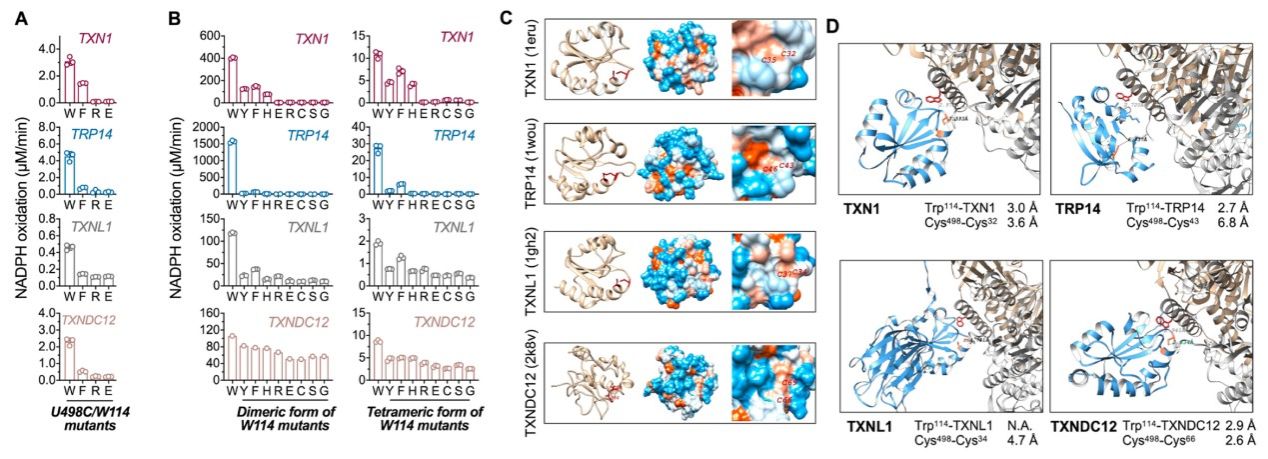
本研究进一步拓展了团队早前关于TXNRD1热稳定性调控机制的探索。继2024年1月在《Redox Biology》期刊报道了导向杆基序(guiding bar motif)在酶活性和热稳定性的作用机制(https://doi.org/10.1016/j.redox.2024.103050),本项研究发现位于导向杆及二聚体互作界面区域的多个芳香族氨基酸残基是维持TXNRD1构象稳定性的关键因素,为理解其构象动态和药物结合特性提供了新的线索。
该研究成果经过同行评议之后,以研究长文(research full article)形式发表在国际自由基生物学与医学领域权威期刊《Free Radical Biology and Medicine》。化工海洋与生命学院2022级硕士毕业生孟瑶、课题组研究助理孙世博为论文的共同第一作者,硕士生汪国英、柳昊雯、张岳、王子晗、本科生时武阳等参与相关研究工作,许建强副教授是论文唯一通讯作者。

同时,本研究还受到辽宁省科技厅联合基金项目(2023-MSBA-019)、辽宁省化学助剂合成与分离重点实验室项目(ZJFK2501、ZJFK2401)、大连理工大学中央高校基本科研业务费项目(DUT24MS019)、国家自然科学基金联合基金重点项目(U22A20455)和面上项目(31670767)等经费资助以及大连理工大学盘锦产业技术研究院的大力支持。
论文链接:https://doi.org/10.1016/j.freeradbiomed.2025.07.009
审核:王天舒