程序性细胞死亡(programmed cell death, PCD)是特定基因介导的细胞死亡,包括凋亡(apoptosis)、坏死性凋亡(necroptosis)、铁死亡(ferroptosis)、双硫死亡(disulfidptosis)等,在机体生长发育过程和机体内稳态维护中发挥重要作用。然而,PCD异常涉及多种疾病病理如肿瘤细胞对凋亡规避、组织损伤或炎性疾病中发生坏死性凋亡和细胞焦亡(pyroptosis)等,同时PCD通路的组成分子可以作为关键的生物标志物或潜在的治疗靶标,这为转化研究和疾病治疗提供了广阔的基础研究场景和诊疗药用前景。
不同PCD具有鲜明的形态学/生化特性,并由不同的信号分子通路驱动。其中活性氧分子(reactive oxygen species,ROS)在ER stress/Mito- dysfunction/DNA damage驱动的caspase-8和caspase-3的活化,亦或LOXs/ACSL4驱动的脂质氧化还原失衡中发挥调控作用。细胞中,硫氧还蛋白还原酶(thioredoxin reductase, TXNRD)作为一种氧化还原蛋白(酶),分布于细胞质有TXNRD1,存在于线粒体有TXNRD2,深刻参与到PCD和细胞命运调控过程,包括自由基清除介导凋亡抵抗、胱氨酸还原促进脂质还原稳态。近年来,生命科学与药学学院许建强课题组坚持致力于PCD中氧化还原生物学研究,聚焦TXNRD1/2等胞内硒蛋白在PCD中的作用和功能,取得新进展。
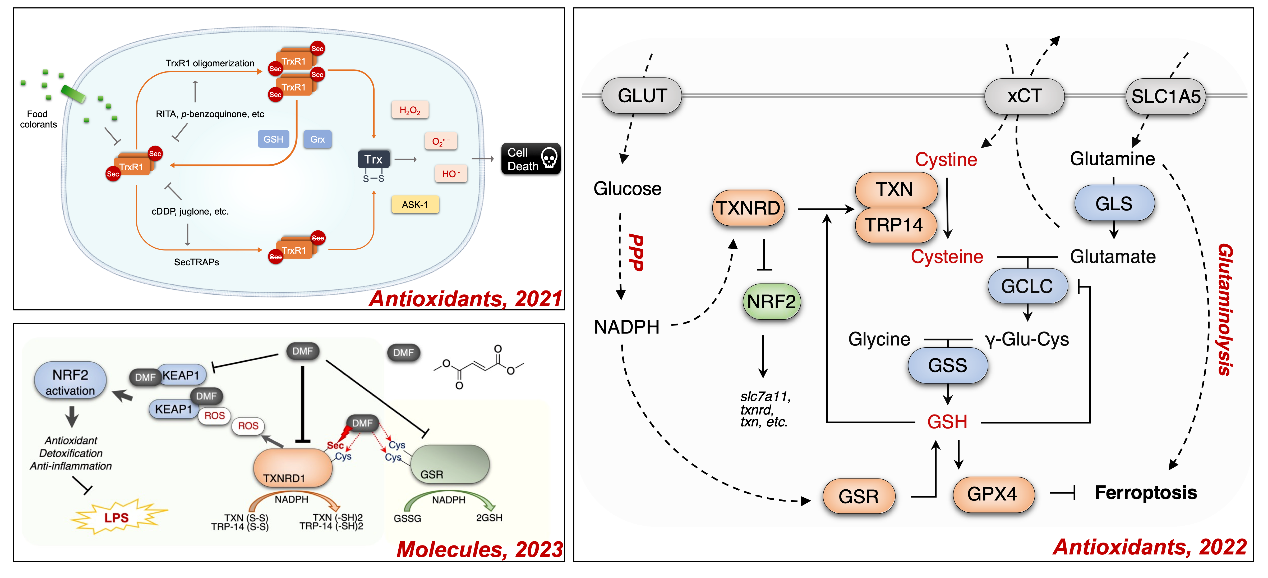
许建强课题组近期研究表明,使用小分子化合物修饰TXNRD1的羧酸末端催化模体中的498位硒代半胱氨酸(selenocysteine, Sec),抑制酶活性并将其转化为促氧化型NADPH氧化酶,快速进行氧化还原循环反应,导致细胞活性氧积累和氧化还原失衡。同时,这种SecTRAPs有效促进了I型铁死亡诱导剂erastin诱导的脂质过氧化和细胞铁死亡,描绘了硒蛋白TXNRD在铁死亡研究版图中不可或缺的作用和位置。相关科研实验结果以大连理工大学为唯一通讯作者单位先后发表于以下主流学术期刊:
Antioxidants_2021, 10, 1733(IF=7.675, JCR_Q1);
Antioxidants_2022, 11, 719(IF=7.419, JCR_Q1)和
Molecules_2023, 28, 107(IF=4.927, JCR_Q2).
以上系列研究受国家自然科学基金面上项目(31670767)、中央高校基本科研业务(DUT17JC36、DUT20LK36、DUT21LK29、DUT21YG117)、辽宁省化学助剂合成与分离重点实验室(ZJKF2004)和大连理工大学盘锦产业技术研究院的资助支持。